あくまでも、世の中にある知識を基にした私の推論であることを、予めご了承ください。
事実関係を確認していないので、間違っているかもしれません。

氷がコップ内で浮かんでいます。
当たり前のことですが、この段階で水より氷の方が軽いことが分かります。

氷を水の中へ入れると、氷は水に浮きまず。
これは、氷に空気が含まれているため、氷が水より軽くなることが理由でしょう。
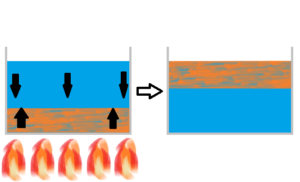
通常、図の様に水を温めると、入れ物下部の水が温まり上昇します。
冷たい水は下降します。
すると図右の様に、温かい水と冷たい水が入れ替わります。
さて、何故温かい水が上昇し、冷たい水が下降するのか考えてみましょう。
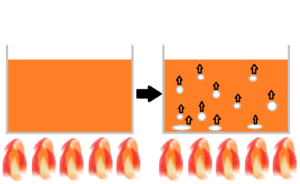
図の様に、容器の中にある水を沸騰させると、容器底から空気が出て上昇します。
私には、この空気が酸素としか思えません。(^^)
つまり、水を沸騰させることにより、水に含まれる酸素の一部が気泡となり、酸素を失った水は軽くなり上昇している。
その為、相対的に軽くなったお湯が上昇するのだと思います。
簡単に言うと、熱を加えられた水素が酸素を放出しているように思えます。
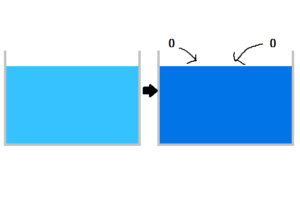
図の様に、水を冷やすことにより、水素が大気中から酸素を取り入れ、水の酸素濃度が高くなり、本質的に完全な水へ近づくのではないかと予想します。
水には水素と酸素の比率があり、特定の比率になると最も重い水、完全な水と化すのではないかと思えます。

では、氷は何故浮くのでしょうか?
これは、水素が水となる場合の許容を大きく超える酸素を取り込んだため、浮くのではないかと思います。
水素は酸素を取り込めず、気泡となり氷の中に酸素を閉じ込めているように思えます。
酸素を多く含む氷は相対的に水より軽くなり、取り込んだ酸素の分、水上へ浮くことになります。
何が言いたいのかというと、水を温めた場合と、水を冷ました場合、水を凍らせた場合、次のような事が起こっていると思うのです。
水を温めた場合
1.酸素を放出する。
2.失った酸素だけ軽くなる。
3.膨張する。
4.水素と酸素の分子が分離し、膨張した水が存在するための空間が必要になる。
暖かい水を冷ました場合
1.酸素を取り込む。
2.取り込んだ酸素だけ重くなる。
3.収縮する。
4.水素と酸素の分子が結合し、結合し水となるため空間が必要なくなる。
凍らせた場合
1.酸素を取り込む。
2.取り込んだ酸素は水と化せず、氷内部へ気泡が出来る為、水上で浮く。
3.収縮する。
4.凍り内部へ気泡が出来、氷が存在するための空間が必要になる。
これが、水素の特徴でしょうか?
同じ水でも、完全な水の比率があり、特定の比率になると最も重い水となるのではないかと思います。
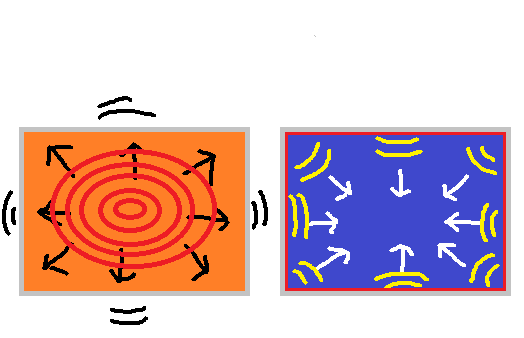
さて、容器にふたをせず水を温めると膨張し、上方向への力が働きます。
水を冷やすと収縮し、下方向への力が働きます。
この力も、水素による酸素の放出/吸収と関係が有るように思えます。
図左を見てください。
この様に、水を温めると膨張するのですが、容器に入っているので膨張しようとする水が容器内へ押さえられ、容器内の圧力(水圧)が高くなります。
容器全体は、内容物の膨張により膨らもうとします。
図右を見てください。
この様に、水を冷やすと収縮するのですが、容器に入っているので容器内の水は収縮することができず、容器内では容器を引っ張ろうとする力が働きます。
その為、水は圧力(水圧)が高くなり重くなるのですが、水周辺の容器と接する部分が引っ張られ、容器と水が接する部分の圧力が下がります。
このような現象の例として、鍋で料理をし、出来た食べ物に蓋し冷まそうとすると内容物が収縮し、蓋が開かなくなったりするんですね。
さて、今回は、水の性質から考える膨張と収縮、水素と酸素の反応についての自論でした。(^^)