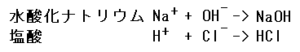今回は、自分なりの考え方で浸透圧がなぜ起こっているかを分析したいと思います。
勿論、今回分析する内容を学校のテストで答えると、点数を取れません。(^^;
今回のお話は、次のお話が関係しています。
1.重心と浮心、幾何中心について
2.重心と質量中心、浮心について
3.浸透圧-学校で習う浸透圧
4。浸透圧-浸透圧を分析
次の順で話したいと思います。
1.圧力を分析。
2.密度を分析。
3.化学を使った分析。
4.数学的な分析。
1.圧力を分析。
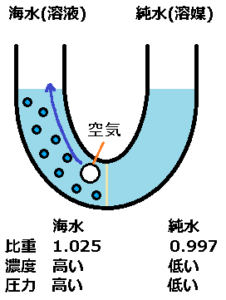
圧力というものは、圧力が高い方から圧力が低い方へ力が流れていきます。
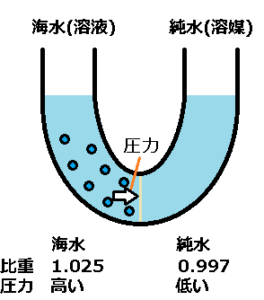
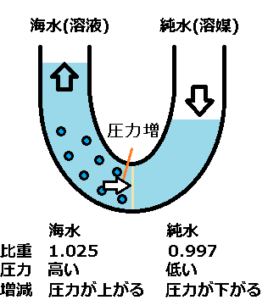
AIによると、4度の純水は比重が1.0g/cm^3、24度の純水は比重が0.997、24度の海水は比重が1.025です。
同じ量の海水と純水の場合、海水の比重が高いので、海水の方が高い圧力だと思います。
溶質は半透膜を通過できないので、半透膜へ溶質の圧力がかかると思います。
加えて、半透膜は水を通すので、圧力により海水から純水へ水が流れ込もうとします。
この時、海水の方は上に水、底ほど濃い海水があり、半透膜により海水は純水へ入ることが出来ません。
海水の水面が上昇すると、この圧力は大きな差になります。
2.密度を分析。
私は長く物理計算をしてきたので、物理計算に関してはある程度できると思っています。
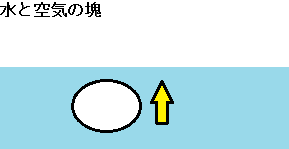
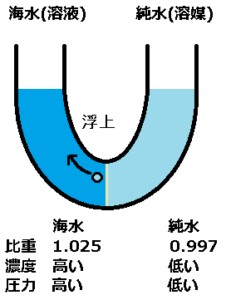
図のように、海水の中に空気を入れると、気体である空気は水上へ浮上しようとします。
図の様に、半透膜を純水が通過したとします。
海水に対して純水は密度が低いので、密度の低い液体は空気と同じように上昇しようとします。
軽い物質は、浮上するのです。
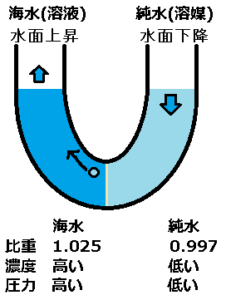
これにより、海水が薄まりながら、海水面が上昇していきます。
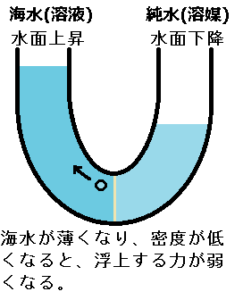
やがて海水は薄くなり、純水と海水の密度が近づいていくと、半透膜を通過した純水の浮上する力が弱くなります。
すると、水面が上昇する力が弱くなります。
3.化学を使った分析。
説明を見ると分かると思いますが、私は化学で説明した経験が少なく、「前回の記事と今回の記事に間違いがあっても気づけない」という事に気をつけてください。(^^;
塩と言えば、Na+とCl-が電荷によって結合するイオン結合ということは有名な話ですね。
NaClを水に入れたとして、Naにエネルギーが加わわることでNa+に、Clは電子を取り込むことでCl-になると思っています。
このNa+とCl-が水に溶けると、NaOHとHClになると思っています。
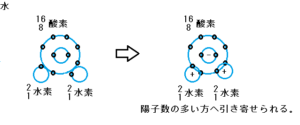
水は、陽子数の多い酸素に電子が引き寄せられ、水素はプラスに、酸素はマイナスへ電荷が偏ります。
この電荷は、プラスとマイナスが引き合います。
酸素はプラスに、水素はマイナスに電荷が偏っているので、図のように酸素と水素は引き合います。
これは、酸素と水素の温度が低いほど、電荷により結合する力が強く働くと思っています。
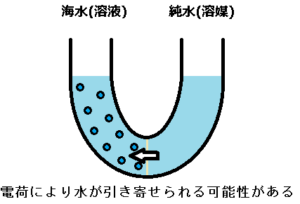
このような電荷により、半透膜から水を引き寄せることがあるのかも知れないと思っています。
化学の説明は、この程度です。(^^;
4.数学的な分析。
浸透圧の計算を分析して、計算が何を示しているかを話したいと思います。
まず、次の式は分かり辛いので変形したいと思います。
Π=cRT
これを見ても意味が分かり辛いと思いますので、文字に変えたいと思います。

この中の、溶液内の溶質量、気体の量を算出する時に使用する定数、絶対温度が何を示すか考えると、次のことが考えられます。
1.溶質の量。
2.熱による溶質の運動量。
3.熱による膨張。

更に、これらを溶液の体積で割っています。
これが何を算出するかを考えると、溶液に対する溶質の濃度だと思います。
溶質の濃度なので、浸透圧が溶質の濃度に影響されていることがわかります。
この時、溶液の比重が高ければ、溶液は密度が高いと言えます。
私はコンピューターで数学計算を何度か試したことがあるのですが、どうも学校の計算は甘く、少し手を加えなければ望んだ結果にならないことがありました。
学校で習うことは基礎なので、実用するとなると応用力が必要になりますね。
勿論、間違っているかもしれないので、「こういう考え方もあるのか」程度にお読みください。
以上